重庆大学王贵学教授团队发现M2型巨噬细胞外泌体可加速血管内支架植入的新生内膜修复
长期从事血管内支架、血管生物力学研究的重庆大学生物工程学院王贵学教授团队在M2型巨噬细胞加速血管内支架植入后新生内膜修复调控机制方面有了新见解。近日在生物医学领域1区Top杂志《Theranostics》(2019 IF: 8.579) 作为内封面文章发表论文,报道了“M2巨噬细胞来源外泌体促进血管内支架植入后血管组织修复过程中血管平滑肌细胞的c-KIT表型转化”的新机制,为临床加速血管损伤后内膜新生提供新方向。

2019年第二十二届全国介入心脏病学论坛发布的中国冠心病介入数据显示,2018年度中国大陆地区采用介入治疗的冠心病病例为915256例,冠心病患者平均植入支架数为1.46个。但研究表明,仍有2%~5%的患者可能在术后8个月~12个月内发生支架内再狭窄。众所周知,更快的新生内膜修复会减少晚期支架内血栓和再狭窄的风险。长期以来,医学界由于对血管新生内膜的形成机制研究尚不清楚。
在此项研究中,研究人员在大鼠腹主动脉支架植入模型中首次发现血管平滑肌细胞在血管损伤过程发生逆分化行为,并且M2型巨噬细胞可能是这一行为发生的诱因。体外Transwell共培养模型建立,确定了M2型巨噬细胞是通过分泌外泌体影响血管平滑肌细胞发生逆分化,逆分化的过程还伴随着这细胞骨架解聚和细胞硬度的降低。进一步,在体验证外源性的加入M2型巨噬细胞分泌外泌体可加速血管平滑肌细胞逆分化的同时亦可以加速支架损伤后的血管再内皮化。最后,通过mRNA-seq筛选验证MAPK/AP-1信号通路在M2巨噬细胞分泌外泌体导致的血管平滑肌细胞逆分化的进程中起关键作用。
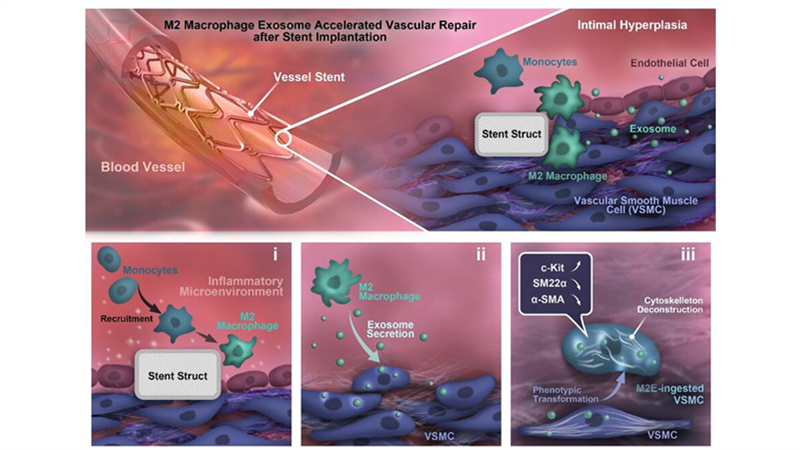
本研究揭示了M2巨噬细胞外泌体作为介导血管平滑肌细胞参与支架植入后加速新生内膜修复的信号,从而调控血管平滑肌细胞逆分化的新机制,为PCI的治疗提供新靶点和新思路,并为PCI的外泌体治疗提供了理论依据。
重庆大学王贵学教授为文章的通讯作者,邱菊辉研究员和Hans Gregersen教授为文章的共同通讯作者,博士生严文华为文章的第一作者。其他参与研究的作者包括重庆大学副教授尹铁英,博士生李天函、侯郑军、瞿凯;英国剑桥大学的 Durken Colm教授、Wang Nan 助理研究员和Dong Lingqing 博士。
近年来,王贵学教授团队先后在《Nature Neuroscience》、《Advanced Science》、《Small》(2篇)、《Theranostics》(4篇)、《NPG Asia Materials》等国际Top期刊系列报道了与国内外合作研究在神经血管耦合、血管生物力学、动脉粥样硬化性心血管病的纳米治疗等领域的研究成果。
本研究获国家自然科学基金(31971242, 31701275)和国家重点研发计划项目课题(2016YFC1102305)等资助。
参考文献:
Yan W, Li T, Yin T, Hou Z, Qu K, Wang N, Durkan C, Dong L, Qiu J, Gregersen H, Wang G. M2 macrophage-derived exosomes promote the c-KIT phenotype of vascular smooth muscle cells during vascular tissue repair after intravascular stent implantation. Theranostics 2020; 10(23):10712-10728.
原文链接:http://www.thno.org/v10p10712.htm
 我要投稿
我要投稿
